用一篇43分文献带你了解单细胞+空间转录组多组学研究思路
编者按
单细胞转录组测序技术将传统的转录组学研究带入了一个新的时代,而空间转录组测序技术的横空出世补全了单细胞转录组测序的不足,补充了基因表达和细胞类型的空间分布。然而,新的技术也带来了海量的数据,使得数据处理和挖掘生物学信息变得更为复杂,需要从新的维度来拓宽课题的研究思路。为此,小编这里用一篇今年2月份发表的利用单细胞+空间转录组测序技术进行多组学研究的高分文献,带大家认识、了解和掌握单细胞+空间转录组测序文章的研究思路。
01 文章详情
文章题目:Single-cell and spatial transcriptomics reveal aberrant lymphoid developmental programs driving granuloma formation
中文题目:单细胞和空间转录学揭示导致肉芽肿形成的异常淋巴发育程序
发表时间:2023.02
期刊名称:Immunity
影响因子:43.474
实验方法:10x 单细胞转录组+Visium 空间转录组+多重免疫荧光染色技术(mIF)
DOI:10.1016/j.immuni.2023.01.014
02 研究思路

小编在这里总结了文章的研究思路和主要结果,方便忙碌的老师们快速了解这篇文章的主要内容。首先,我们先弄清楚作者是如何对样品进行分组的,每组有多少重复。这是整个实验设计中最重要的部分,分组是否正确,样品是否有代表性都影响整个研究结果的正确性。在本文中,作者收集了12例结节病患者(8女4男)配对的病变和非病变皮肤组织,并对12例患者配对样品进行了单细胞转录组测序,而空间转录组测序和mIF只在12例患者的病变样品中进行检测。如果对文章具体内容感兴趣,请听小编娓娓道来。
03 研究内容
1、研究背景
一篇多组学文章,先弄清楚研究背景,可以更好地帮助我们了解作者的研究思路,以及行文逻辑。这篇文章首先介绍了肉芽肿这一结构的定义和特征,表明其可能导致多种疾病、纤维化、器官损伤和炎症,危害健康。同时简单总结了前人针对肉芽肿研究的各种成果,并指出免疫细胞和结构细胞间的相互作用有助于维持肉芽肿性炎症和结构。因此,作者选用了结节病作为非感染性肉芽肿疾病的研究模型,来探究肉芽肿形成的机制。利用单细胞转录组+空间转录组测序技术,从单细胞水平解析肉芽肿内细胞的空间图谱,并利用mIF技术加以验证。接下来,小编将详细解读本文主要结果。
2、单细胞转录组+空间转录组测序确认三种与肉芽肿相关的重要细胞类型
单细胞转录组结果聚类得到了20个细胞群,并鉴定为8种细胞类型:淋巴细胞、髓系细胞、角质形成细胞、肥大细胞、成纤维细胞、内皮细胞、周细胞和黑色素细胞。其中,cluster0(病变巨噬细胞)、cluster1(病变Th细胞)和cluster9(病变成纤维细胞)几乎只存在于病变皮肤中。通过mIF也确认肉芽肿内的主要细胞类型为CD3+ T细胞、CD68+巨噬细胞和CD90+成纤维细胞。空间转录组结果聚类得到四个区域,其中cluster3只存在于包含血管组织的样本中,而其他三个cluster作者基于组织学先验知识分别注释为肉芽肿性真皮区、未受影响的真皮区和表皮区。接下来,利用解卷积算法联合分析单细胞转录组和空间转录组结果,发现上述三种病变亚群主要分布在肉芽肿性真皮区域。这些结果表明这三种细胞类型可能与肉芽肿的形成与维持密切相关。下面将分别介绍它们的功能和特征。
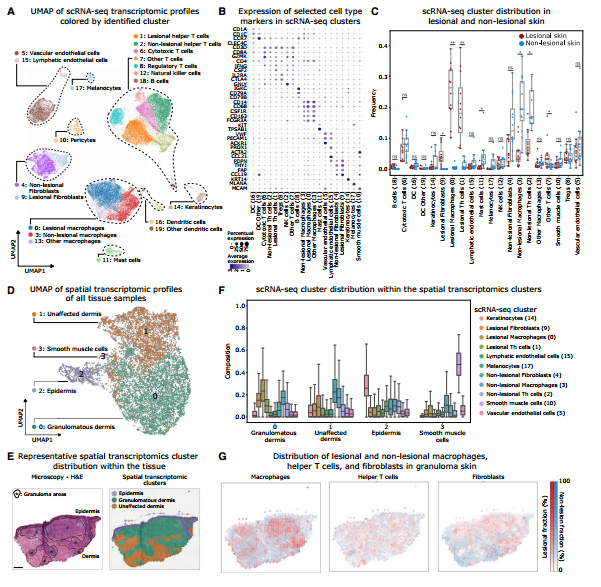
Fig.1 肉芽肿内富集了特定的巨噬细胞、T细胞和成纤维细胞亚群
3、GA巨噬细胞表现出强烈的促炎特征
对所有巨噬细胞重新聚类,得到两个细胞群。其中一群主要来自病变皮肤,命名为肉芽肿性巨噬细胞(GA巨噬细胞),另一群主要来自非病变皮肤,命名为稳态巨噬细胞。GA巨噬细胞高表达皮肤结节病相关基因、S100A8/9、炎性和IFNγ激活的巨噬细胞相关基因、细胞溶解和ECM成分基因。炎症相关转录因子在GA巨噬细胞中上调并在肉芽肿内表达,该细胞群的代谢特征与肿瘤微环境相关条件类似。为进一步描述GA巨噬细胞的特征,将GA巨噬细胞细分为2个亚亚群:GA0和GA1。GA0上调表达结节病相关基因、基质金属蛋白酶基因(在ECM降解中起作用),而这些基因在G1中下调,说明了两个亚亚群调节免疫细胞在肉芽肿内的转移和维持方面存在功能异质性。GA0还高表达CSF1(编码M-CSF),从而增加局部组织炎症反应。综上所述,肉芽肿内高度炎症的环境是由GA巨噬细胞塑造的,其通过支持适应性免疫和ECM重塑来维持肉芽肿中的炎症微环境。
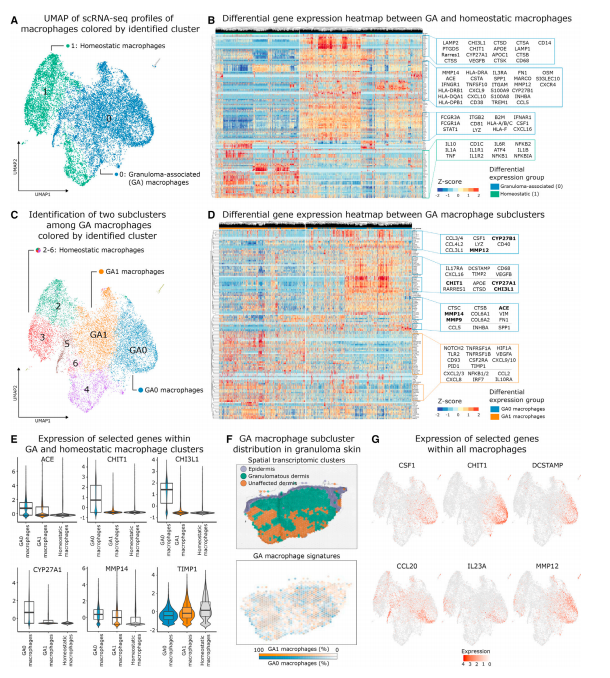
Fig.2 GA巨噬细胞具有强烈的促炎特征
4、肉芽肿内富含Th17.1表型的T细胞
将淋巴细胞重新聚类,发现Th细胞占大多数。其中一群在病变与非病变组织中均存在,命名为稳态Th细胞,而另一群主要存在于病变组织,命名为GA Th细胞。GA Th细胞高表达一些转录因子、细胞因子(及受体)、趋化因子(及受体)的基因和LTB。而免疫调节基因PDCD1和CTLA4在GA Th细胞高表达,表明慢性T细胞刺激和随之而来的T细胞耗竭。细胞溶解相关基因的高表达暗示GA Th细胞可能具有细胞毒性。有趣的是,GA Th细胞似乎已获得慢性激活的Th17.1细胞表型,因为Th17.1的特征和依赖的转录因子在GA Th细胞和肉芽肿区域高表达。此外,Th17.1通过CCL20-CCR6招募,免疫荧光染色确认肉芽肿内的CD3+T细胞与CCR6的表达共定位。这些结果表明,肉芽肿内持续的刺激导致Th细胞向Th17.1表型分化,从而促进巨噬细胞活化和炎症。肉芽肿的生成与TLS有一定相似性。总之,GA Th细胞似乎以MHCII限制性方式诱导巨噬细胞活化并发挥细胞毒性功能,最终导致T细胞在这种炎症环境中衰竭。

Fig.3 肉芽肿中富含Th17.1表型的T细胞
5、结构细胞促进肉芽肿的局部炎症和组织重塑
对所有成纤维细胞重新聚类,根据细胞来源将主要与非病变皮肤相关的亚亚群命名为稳态成纤维细胞,与病变皮肤相关的亚亚群命名为GA成纤维细胞。进一步聚类将GA成纤维细胞分为2群,一群为免疫互作成纤维细胞,表达参与细胞招募和保留、抗原呈递等免疫功能基因。另一群为组织重塑成纤维细胞,高表达ECM、血管生成调节、肿瘤侵袭和增殖相关基因。接下来,我们来确定这些成纤维细胞的空间位置分布。通过各成纤维细胞亚型特征基因集表达水平,作者确认稳态成纤维细胞位于肉芽肿区域外,而免疫互作成纤维细胞紧邻这些区域,位于中间区域,而组织重塑成纤维细胞主要位于肉芽肿区域内部,表明ECM成分是在这些炎症结构内分泌的。
比较GA和稳态成纤维细胞中转录因子基因表达水平以确认有助于结节形成的转录因子,发现GA成纤维细胞高表达免疫、成纤维细胞极化和促纤维化相关转录因子基因。将两种GA成纤维细胞亚型比较发现,发现免疫互作成纤维细胞高表达发育和干扰素反应相关的转录因子基因。这些结果可能有助于解释在皮肤肉芽肿中观察到的固有免疫功能和炎症表型。

Fig.4 PPI网络的功能聚类分析
6、肉芽肿内免疫细胞和结构细胞的互作网络
在3、4、5三个部分我们已对三种重要的细胞类型的特征和功能进行了概述。但疾病的表型和特征不仅仅是疾病区域微环境内细胞单独发挥功能的结果,不同类型细胞间的细胞通讯也尤为关键。因此,基于配体受体基因表达关系,我们来讨论本文中三种重要的免疫和结构细胞的互作关系。在本文中,细胞互作关系通过三种方式确认:互作基因对表达水平、互作基因对在空间转录组结果的表达共定位和互作基因对在mIF结果的表达共定位情况。研究的配体受体关系对主要分为三类:分泌因子介导的细胞互作、控制与临近细胞的结构互作和黏附支撑,以及免疫调节。由于篇幅原因,这里不对互作结果进行详细描述,感兴趣的老师可以阅读原文。基于细胞互作分析结果,作者推测肉芽肿内的T细胞、巨噬细胞和结构细胞间密集的互作关系可能有助于促炎环境以及驱动结节病病理的免疫细胞的吸引和保留。其中三个调节过程对于肉芽肿形成至关重要:血管生成和免疫代谢、细胞因子和趋化因子信号传导、ECM重塑。
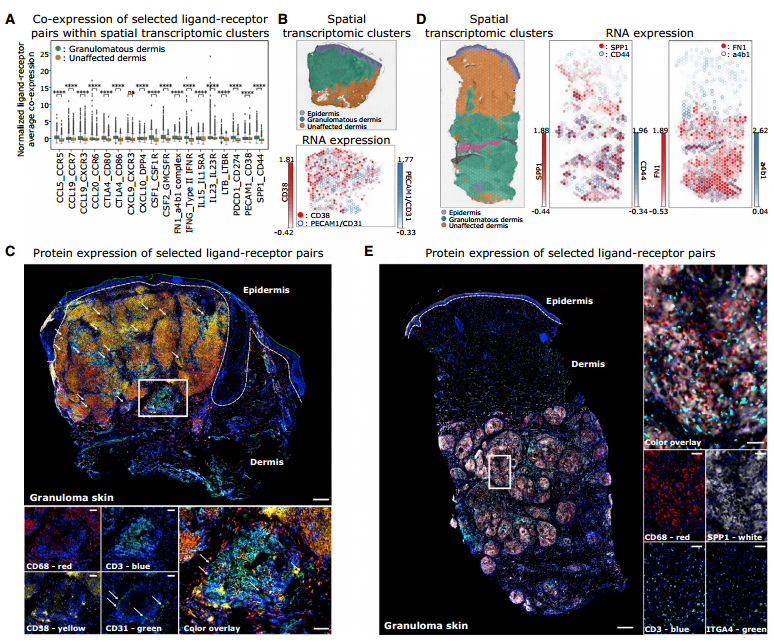
Fig.5 结构细胞促进肉芽肿局部炎症和组织重塑
7、肉芽肿与TLS具有相似性
在上文描述肉芽肿内T细胞功能时有提到过肉芽肿与TLS具有一定相似性。这里,作者对二者的相似性进行详细论述。首先,12个TLS特征趋化因子基因集在肉芽肿结构内高度表达。其次,参与T细胞向淋巴器官归巢的CCL19-CCR7/CXCR3通路在肉芽肿内特异性表达。然而,二者也具有一些差异。例如,肉芽肿中Th细胞促进巨噬细胞活化,而不是像在癌症中的减弱炎症作用,说明肉芽肿的形成利用一些与TLS形成相同的生物学过程,但与生理正常的TLS不同,形成了一个非正常的淋巴器官。
8、基质金属蛋白酶可能是抑制肉芽肿形成的候选靶点
基于单细胞转录组、空间转录组和mIF结果,我们已详细论述了肉芽肿中重要的细胞群及其功能、肉芽肿内细胞互作网络和肉芽肿与TLS的异同。接下来,作者想将这些结果应用于治疗实践当中。为此,作者将目标放在了在GA巨噬细胞中上调表达的MMP12上,因为其可能在ECM形成和免疫细胞激活中发挥功能,并且已有报道表明与肺部肉芽肿的临床进展相关。用MMP12抑制剂FPA-014治疗小鼠,四周后发现肢体和尾部肉芽肿诱导的皮肤肿胀明显减轻,这支持了基质金属蛋白酶在肉芽肿形成和维持中的发挥功能。
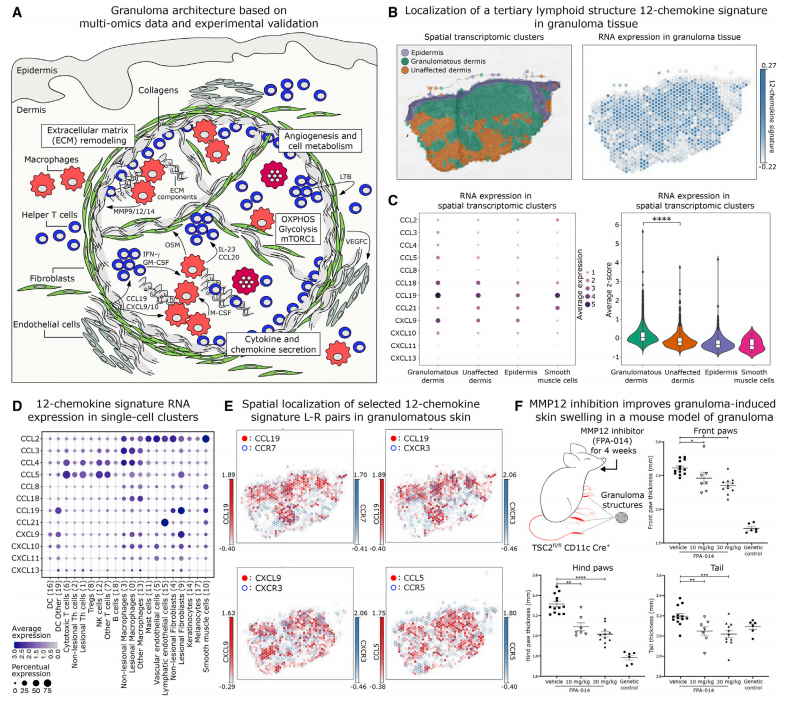
Fig.6 肉芽肿与TLS具有相似特征
04 结果总结
到这里,小编已经将这篇文献的主要内容介绍完毕,我们总结一下这篇文章的主要思路和结果。首先,利用单细胞转录组测序和空间转录组联合分析结果,鉴定出肉芽肿形成的三个关键细胞类型:代谢重编程的巨噬细胞、产生细胞因子的Th17.1、具有炎症和组织重塑表型的成纤维细胞。整合这些细胞的基因表达、富集功能和互作关系结果,发现肉芽肿利用与淋巴器官发育相关的转录程序形成一种免疫刺激环境。肉芽肿的形成涉及与免疫代谢、细胞因子和趋化因子信号传导、ECM重塑相关基因。最后,小鼠模型实验确认靶向基质金属蛋白酶药理学抑制可减弱肉芽肿的形成。综上所述,人肉芽肿采用了与TLS类似的调控机制,但未能形成正常生理的TLS结构,而形成异常淋巴器官。
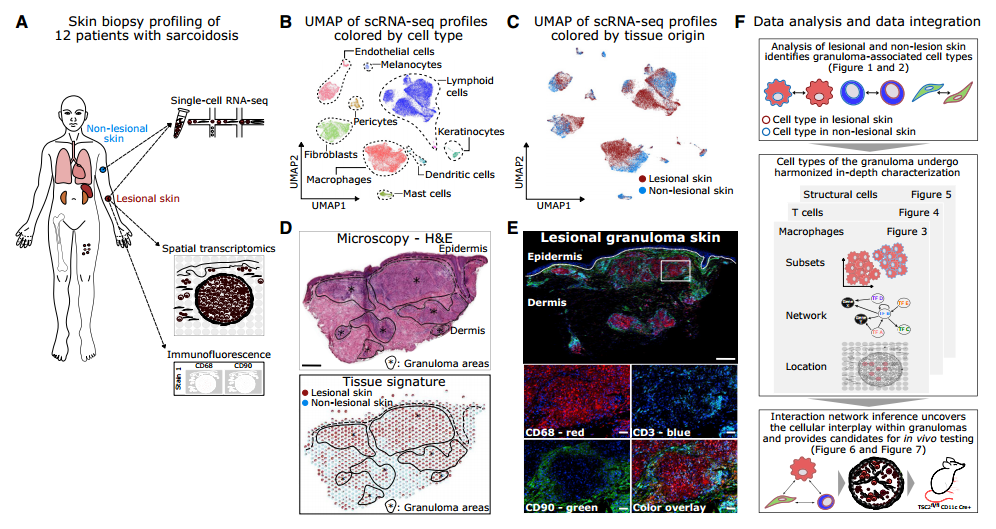
Fig.7 文章思路
参考文献:
Krausgruber, Thomas et al. “Single-cell and spatial transcriptomics reveal aberrant lymphoid developmental programs driving granuloma formation.” Immunity vol. 56,2 (2023): 289-306.e7.
新闻中心
News Senter
上海生物芯片有限公司
Shanghai Biochip Co., Ltd.
版权所有©上海生物芯片有限公司
电子邮箱:
marketing@shbiochip.com
地址: 上海市浦东新区张江高科技园区李冰路151号
技术电话:
4001002131
扫描查看
微信公众号

